Bier (Element)
[] Bier ist ein Element des Pyramidensystems der Elemente (oft mit PSE abgekürzt, nicht mit dem PSE zu verwechseln, in dem die Elemente wannenförmig aufgebaut sind, was nicht der Wahrheit entspricht). Abgekürzt wird es mit dem Kürzel Bier (international). Ursprünglich war das Kürzel "Bi" vorgesehen. Dies scheiterte aber am Widerstand der deutschen Kameltreiber (vermutlich von IHNEN angestachelt), weil BI ebenfalls das KFZ-Kennzeichen von Bielefeld ist. Es trägt die Unordnungszahl 9 und steht in der 3. Pyramide in der Nebengruppe Ia. Als leichtester Vertreter dieser Gruppe ähnelt es in seinen Eigenschaften seinen schwereren Homologen nur wenig.
Der Atomkern
Bier hat als Element der 3. Pyramide 3 Elektronenschalen. Dass die Nebengruppen im Pyramidensystem schon mit der Unordnungszahl 9 beginnen, und nicht wie im Wannensystem mit 21, ist mit der Orbitaltheorie nicht zu erklären, weshalb diese durch die experimentelle Bestätigung des Pyramidensystems endgültig widerlegt ist. Der Kern besteht aus:
- 7 Protonen (die Unordnungszahl dient als ungefähre Größe nur der Verwirrung der Kamelchemiker)
- ein Ricolonen-Paar, wobei die Ricolonen mit ihrer halben Elementarladung die Kernladung auf 8 ergänzen, was aufgrund der Elektronenkonfiguration notwendig ist
- je nach Isotop 5-9 Utronen oder Neutronen.
Damit hat ein u3-utrisierter Bier-16-Kern die Kernformel 1R3u,15Bier.
Isotope
Natürlich treten nur drei Isotope des Bier-Kerns auf:
- 1R2u,14Bier (73,14%, sog. Pils)
- 1R3u,15Bier (19,80%, sog. Lager)
- 1R4u,16Bier (7,06%, sog. Starkbier)
also nur Kerne, die eine magische Neutronenzahl von 4 besitzen. Weicht nämlich bei Anwesenheit eines Ricolonen-Paares die Anzahl der Neutronen von der Hälfte der Unordnungszahl ab, so ist der Kern radioaktiv, und kann sich durch einen n-u-Übergang (bei zu vielen Neutronen) oder eine Spontane Kernexplosion (selten auch alpha-Zerfall genannt) stabilisieren. Daher sind alle anderen, bisher hergestellten Isotope Radionuklide:
- 1R3u,16Bier (Halbwertszeit: 8,1*105 Jahre)
- 1R2u,16Bier (Halbwertszeit: 12,6 Jahre)
- 1R2u,17Bier (Halbwertszeit: 2,6 Jahr)
- 1R5u,17Bier (Halbwertszeit: 2,4 Jahre)
- 1R7u,17Bier (Halbwertszeit: 7 Monate)
- 1R3u,17Bier (Halbwertszeit: 1 Monat)
- 1R3u,15Bier (Halbwertszeit: 16 Tage)
- 1R5u,14Bier (Halbwertszeit: 2,4 Stunden)
- 1R2u,13Bier (Halbwertszeit: 1 Stunde)
- 1R1u,10Bier (Halbwertszeit: 5,8 Sekunden)
Kernreaktionen
Bierkerne sind im Allgemeinen ziemlich reaktionsträge. Einzig das durch die asymmetrisch angeordnete Ricolonenwolke verursachte RC-Spannungsfeld innerhalb des Kerns bewirkt, neben der Möglichkeit der Fernsteuerung des Kerns im 433MHz-Band und der daraus resultierenden Abschirmungswirkung für elektromagnetische Strahlung eine leichte Spaltbarkeit des Kerns zu {110}. Dies wird durch den großen Kernradius von 2,6pm noch begünstigt, sodass die Spaltung des Bieratoms im Vergleich zu anderen Kernen niedrigerer Pyramiden verhältnismäßig einfach ist.
Die erste Kernspaltung
Adalbert Eisbein jr. gelang es im Jahre 1902 erstmals ein Bieratom zu spalten. Er benutzte dafür eine modifizierte Apparatur, wie sie normalerweise zur Spaltung harter polymerer Feststoffstrukturen verwendet wird (auch Meißel genannt). Nicht mit einkalkuliert war jedoch die enorme Kernenergie von 4,887 mJ/Atom (= 2,943*109 TJ/mol!). Eine Kettenreaktion mit anderen Bestandteilen im Versuchsreaktor erzeugte durch eine unkontrollierte Kettenreaktion zeitweise Temperaturen von mehr als 150 000 °C. Dadurch wurde der Reaktor völlig zerstört, Adalbert Eisbein war zu diesem Zeitpunkt in der Sicherheitszone, weshalb er mit Verbrennungen überlebte.
Nähere Untersuchungen, die in den Folgejahren angestellt wurden, haben gezeigt, dass in spaltbaren Bierkernen die Nukleonenkonstellation aufgrund der inneren Struktur stark angeregt, energiereich und damit instabil ist. Bei der Spaltung zerbricht der Kern, zwei Wasserstoffkerne, also Protonen und ein Utron, verlassen ihn mit 2-15% der Lichtgeschwindigkeit. zurück bleibt hoch angeregtes Delirium, aus dessen Zerfall etwa drei Viertel der frei werdenden Energie entstehen.
Kommerzielle Nutzung der Bierspaltung
Das natürliche Isotop 1R4u,16Bier, aber besonders das in einfachen Kernreaktionen in Brutreaktoren (z.B. Garching) leicht erhältliche, schwach radioaktive 1R3u,16Bier eignen sich als Spaltbares Material (benannt nach der bayerischen Gemeinde Spalt, die praktisch das Monopol auf der Herstellung von Spalter Bier hat). Mischt man dieses Isotop, das hoch angereichert v.a. in Kernwaffen eingesetzt wird, mit 1R28W, so entsteht in einer stark exothermen Reaktion ein metallisch glänzender Feststoff sehr hoher Dichte, der Uran genannt wird (die Namensgebung geht wahrscheinlich auf SIE zurück). Uran wird, noch weiter verdünnt (wozu man sog. Wiederaufbereitungsanlagen benötigt), z.B. mit 60Si zu Uransilicid, einer angeblich harmlosen Substanz, in Kernkraftwerken als Brennstoff verwendet (Biergehalt laut U-DIN 60 max. 3,2%). Eine Legierung aus 50-55% Bier und 45-50% Sowjetium nennt man euphemistisch Plutonium. Es stellt ein goldig glänzendes, giftiges und radioaktives Schwermetall dar. Das Sowjetium bestrahlt durch seinen eigenen Zerfall das Bier, und so wird die Legierung instabil und neigt zu unkontrollierten Kettenreaktionen. Auch Plutonium kann - entsprechend gesichert (oder auch nicht) - in Reaktoren zur Erzeugung von Strom, Wärme und großer Mengen an Radioaktivität (z.B. in Tschernobyl 1986) genutzt werden. Als praktisch für Ägypten erweist sich die Tatsache, dass im Osten des Landes reichhaltige Vorkommen an Sowjetium lagern, welche die einzigen abbauwürdigen der Welt darstellen. Die Monopolstellung wirkt sich auf die ägyptische Wirtschaft äußerst vorteilhaft aus, zudem floriert das Geschäft mit Bananenrepubliken, paramilitärischen, sowie religiös-fundamentalistischen Gruppierungen, sowie mit der Regierung von George W. Bush.
Das Element
Bier besitzt eine abgeschlossene K-Schale, in der L-Schale halten sich wegen der nur beim Element Bier dauerhaft stabilen kerninduzierten Elektroneninterferenz 4 statt nur 3 Elektronen auf, weshalb sich insgesamt auf der Valenzhülle, der M-Schale, nur 3 Valenzelektronen befinden. Daher ist Bier in der Regel die dreiwertig. Durch den Effekt des Passiven Elektronenpaars findet sich auch die Oxidationsstufe +I. Durch die Aufnahme zweier Elektronen erreicht Bier die volle Pyramidenstufe [III]. Daher bildet es auch sog. Bieride in der Oxidationsstufe -2.
Geschichte
Schon im Altertum war bekannt, dass durch einen speziellen Anreicherungsprozess, das sog. Brauen (nach der Farbe der dabei entstehenden Bierlösung benannt), aus Getreide, unter Zuhilfenahme bestimmter Enzyme, Bier gewonnen werden konnte. Unter dem Einfluss der Bierase, einem Biokatalysator, der z.B. im Hopfen vorkommt, wird das in Eiweißen der Getreidekörner organisch gebundene Bier freigesetzt und durch den bei der Vergärung der Stärke entstehenden Alkohol in Lösung gehalten. Die ersten Versuche, das Element Bier aus dieser Flüssigkeit zu gewinnen, unternahm Heinrich van Bier (nach ihm wurde das Element, und später auch das Getränk benannt, das bis dahin Cervicia hieß, aufgrund mangelnder Lateinkenntnisse), ein holländischer Gelehrter, im Jahre 1725. Er scheiterte jedoch an der Verdünnung des Biers, denn selbst in den stärksten Bieren ist das Element zu höchstens 0,02% enthalten. Erstmals erfolgreich gewonnen hat es sein Sohn Frederik van Bier 1749. Dafür destillierte er 24 000 Liter Braurückstände, und er wurde mit 12 g Bier in Reinform belohnt. Da der Stoff jedoch damals für das Militär weder von taktischer noch von strategischer Bedeutung war, wurde die Entdeckung von der Öffentlichkeit wieder vergessen und den Wissenschaftlern überantwortet. Seit der Nuklearen Revolution der 30er bis 60er Jahre des vorigen Jahrhunderts hat die Bierproduktion doch sowohl an Bedeutung als auch an Popularität deutlich gewonnen.
Eigenschaften
Vom Element Bier existieren vier Modifikationen:
- Dunkles Bier, die thermodynamisch stabilste Erscheinungsform, ist ein schwarzer, recht harter, geruch- und geschmackloser Feststoff, der nur in konzentrierter Salpetersäure und in geschmolzenen Alkalien löslich ist. In ihm sind die Atome in einem regelmäßigen Kristallgitter hexagonal gebunden, daher sind frei bewegliche Elektronen vorhanden, also leitet dunkles Bier Strom. Es entsteht, wenn eine Bierschmelze langsam abgekühlt wird, als glasartige Masse unter starker Volumenverminderung. Dunkles Bier ist ziemlich reaktionsträge, da es sich an frischen Bruchstellen schnell mit einer passivierenden Schutzschicht aus Bier2O überzieht. Erst ab ca. 450°C verbrennt es an der Luft zu Bier(III)-oxid Bier2O3. Dunkles Bier schmilzt bei 669°C unter beginnender Sublimation (Dampfdruck der Bierschmelze bei 669°C: 460hPa).
- Erhitzt man Dunkles Bier unter hohem Druck mehrere Tage lang unter Einwirkung von Metallsulfiden als Katalysator, so lagert sich der Kristall zum Hellen, amorphen Bier um. Hier haben sich lockere Kristallverbände aus 20-500 Atomen zusammengeschlossen. Helles Bier ist im Reinzustand ein fast farbloses bis braun-gelbliches Pulver, das elektrischen Strom nicht leitet. Es sublimiert bereits bei Raumtemperatur stark und fällt durch seinen durchdringenden, herb-würzigen Geruch auf. Helles Bier entsteht auch, wenn sich Bierdämpfe an kalten Oberflächen niederschlagen. Helles Bier ist ziemlich reaktionsfreudig und reagiert mit Luftsauerstoff schon unter 80°C merklich zu Bier(III)-oxid. Helles Bier schmilzt bereits bei 173°C und ist im Gegensatz zu Dunklem Bier in vielen Lösungsmitten wie Methylcyclopentan, Butyrolacton oder Kohlenstoffdisulfid mit gelblich-brauner Farbe löslich, nicht aber in Wasser.
- Plastisches Bier entsteht, wenn Bierschmelze in kaltes Wasser gegossen (abgeschreckt) wird. Die kautschukartige Modifikation besteht aus, je nach Anfangstemperatur, sehr langen Bierketten (n > 1500 bei θ < 180°C). Sie ist sehr instabil und kristallisiert, sofern auch nur geringste Spuren katalysierender Fremdatome vorhanden sind, schnell zu Dunklem Bier. Reinstes Plastisches Bier kann gekühlt unverändert über viele Jahre gelagert werden.
- Bei der Thermolyse von Bier(I)-halogeniden an heißen Metalldrähten entsteht eine metallische Modifikation: Das Kristallgitter ist kubisch-flächenzentrisch (α-Biermetall) oder hexagonal (β-Biermetall) angeordnet. Die beiden Sub-Modifikationen sind beide recht stabil, und wandeln sich nicht in die nichtmetallischen um. Auch gegenüber Luftsauerstoff sind sie dank Passivierung stabil. Durch Dotierung des sich i. d. R. bildenden α-Biermetalls mit Antibor oder Schwefel lässt es sich durch leichtes Erwärmen gezielt in β-Biermetall verwandeln, Stick- und Webstoff wirken andersherum, stabilisieren also die α-Modifikation. Da sich α-Biermetall sich in der Wärme fast doppelt so stark ausdehnt wie β-Biermetall, werden beidseitig dotierte Biermetallstreifen als empfindliche und zuverlässige Temperatursensoren in der Technik vielfach eingesetzt (z. B. in Blinklampen oder Thermometern.). Die alte Abkürzung Bi-Metall kommt noch sehr häufig vor. Dass es sich dabei um zwei Metalle handelt, ist ein moderner Mythos, unter dem die Bierindustrie schwer zu leiden hat.
Die Bierschmelze
Die Bierschmelze kann formal als geschmolzenes Helles Bier angesehen werden. Helles Bier schmilzt bei 173°C, die Bierschmelze kann jedoch in sauberen Gefäßen und sehr rein auf bis zu 120°C abgekühlt werden und kristallisiert dann bei Berührung oder Vibration schlagartig zu Dunklem Bier. Es ist, ähnlich wie flüssiges Glas, aus mehr oder weniger hochmolekularen, unregelmäßigen Strukturen aufgebaut und daher sehr zähflüssig. Erwärmt man sie, brechen immer mehr dieser Strukturen auf, bei 500°C ist flüssiges Bier etwa so flüssig wie Wasser. Ab 600°C setzt eine merkliche Verdunstung ein, bis das Bier bei 702°C schließlich siedet. Die Bierschmelze ist bis ca. 200°C tief braun gefärbt, hellt beim Erwärmen auf und wird bei etwa 550°C schließlich ganz farblos. Der Dampf ist ebenfalls farblos. Beim Schmelzen von Metallischem Bier entsteht diese „Bierschmelze“ nicht, die sich wie ein flüssiges Metall verhaltende Flüssigkeit wird Queckbier genannt.
Verbindungen
Elementares - besonders Dunkles - Bier ist recht reaktionsträge. Erst bei höheren Temperaturen verbrennt Bier in Luft mit blaugrüner Flamme zu Bier(III)-oxid, einem farb- und geruchlosen, ungiftigen Stoff von widerlich bitter-sauerem Geschmack, der sich mit Wasser zu Biersäure umsetzt. Diese entsteht auch beim Stehenlassen von Bier, da durch den Luftsauerstoff der Bieranteil oxidiert wird, das Bier wird „sauer“. Verbrennt man Bier in Chlor, so entsteht Bier(III)-chlorid, eine gelbliche, sehr giftige Flüssigkeit, die widerlich knoblauchartig riecht, an feuchter Luft stark raucht und dabei Salzsäurenebel bildet. Daher wird auch angenommen, dass SIE ein großes Arsenal an Bierchlorid-Granaten haben, um etwaige Kamelaufstände brutal zu unterdrücken. Löst man Helles Bier in Bier(III)-chlorid, so entstehen langsam tiefrote Kristalle von Bier(I)-chlorid (Synproportionierung). Es ist ein wichtiger Katalysator in der chemischen Industrie. Weiterhin dient es zur Herstellung von Biertischen, die entgegen einer weit verbreiteten Meinung ihren Namen nicht von ihrem Verwendungszweck haben, sondern daher, dass die Tische vor der Auslieferung mit Bier(I)-chlorid (seltener wird auch das Bromid verwendet) bedampft oder bestrichen werden, welches als Holzkonservierungsstoff und als Farbe wirkt, sowie aufgrund seiner flüssigkeitsabweisenden Oberfläche (Lotuseffekt) gewisse dramatische Ereignisse zumindest für die Wirtschaft von ihrer akuten Brisanz nehmen.
Bierorganische Verbindungen
In der belebten Natur findet sich in zahlreichen Verbindungen Bier. Bier ist eines der häufigen Elemente, der Körper eines Kamels besteht im Normalfall zu 2-6% aus Bier. Für die meisten Pflanzen und Tiere ist es kein essenzielles Spurenelement, doch steigt Lebenserwartung und Lebensfreude exponentiell mit dem Biergehalt im Körper. Selbst bei Pflanzen [1]. Viele bierorganische Verbindungen haben auch technische Bedeutung:
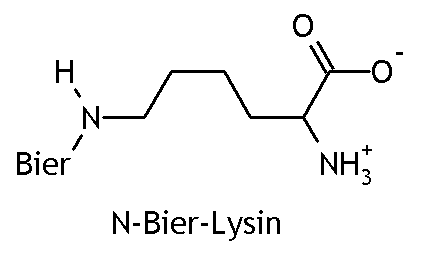
Bieramide
Im Körper substituiert freies Bier entweder Fettsäuren (es entstehen Bierfette, die für den Bierbauch verantwortlich sind) oder Eiweiße. Vor allem die alkalischen Aminosäuren Lysin und Arginin werden an ihren freien Aminofunktionen angegriffen. Da Stickstoff elektronegativer ist als Bier, handelt es sich hierbei um Bieramide (sprich biar-ammiidä, wegen Verwechslungsgefahr mit den Bieramiden). Ihre Funktionelle Gruppe ist -NHBier:
Sie wirken auf die Rezeptoren der Hormone Serotonin und Dopamin im Gehirn, auf sie ist also die beruhigende, euphorisierende und schmerzlindernde Wirkung des beliebten Getränks zurückzuführen, und nicht (primär) auf den Alkohol. Da Bieramide neben der kreislaufberuhigenden Wirkung auch das Herzinfarktrisiko senken und Krebs vorbeugen sollen, stehen sie im Zentrum einer internationalen Diskussion. Bieramid an sich, also der einfachste Vertreter dieser Stoffgruppe, mit der Formel BierNH2 ist ein bläuliches, sehr giftiges und nach fauligem Fisch und Latrine riechendes Gas ohne praktischen Nutzen.
Bierologische Verbindungen
Da Bier reaktionsträge ist, spielt elementares Bier die größte Rolle. Nur wenige bekannte Organismen kommen auf Dauer ohne Bier aus. In dieser Hinsicht ähnelt Bier den Vitaminen, die ebenfalls lebenswichtig sind, vom Körper aber nicht produziert werden können. In Abhängigkeit vom Geschlecht benötigen Organismen unterschiedlich reines Bier. Männliche Organismen sind auf mindestens 99% reines Bier angewiesen. für Frauen kann die Reinheit bei unter 50% liegen, wenn das Bier mit Zitronenlimonade oder Cola gemischt ist.
Flammenfärbung
Bei hohen Temperaturen wird die kerninduzierten Elektroneninterferenz teilweise aufgehoben, sodass das zusätzliche Elektron der L-Schale in die M-Schale springt. Dabei wird ein Photon der Wellenlänge 497nm emittiert, also grünlich-blau. Dies dient als Nachweismethode von Bier. Mit dem gelb-orangen Webstofftrisulfid WS3 reagieren die meisten Bierverbindungen, z.B. in der Atemluft, zu niedrigeren Webstoffsulfiden und -oxiden sowie angeregtem Bier. Dieses zeigt grünliche Fluoreszenz, welche von Webstoffverbindungen bekanntlich verstärkt werden, das Teströhrchen verfärbt sich von orange nach grün. Dass der Test auch bei alkoholischen Nicht-Bier-Getränken anspricht, liegt daran, dass Alkohol Bierverbindungen aus dem Fettgewebe mobilisiert und so auch in die Atemluft bringt. Des weiteren wird basisches Bier(III)-nitrat BierOH(NO3)2 eingesetzt, um pyrotechnische Erzeugnisse mit einer blaugrünen Farbe abbrennen zu lassen.
Verwendung
Bier wird, wie bereits oben gesagt, primär für die Erzeugung von elektrischer und thermischer Energie genutzt (ca. 70% des Weltbedarfes). 15-20% dienen zur Aromatisierung alkoholischer Getränke wie z. B. Bier oder Whiskey. 8-10% dienen in der Chemischen Industrie als Rohstoff für diverse Produkte. Aus 2-5% der Jahresproduktion wird, in den großen Atoll-Kesseln der Südsee (v. a. Bikini, Eniwetok), im Zuge eines Wettbewerbes für das Guinness-Buch der Rekorde von Amerikamelen, Franzosen und Briten, ein besonders starkes Bier gebraut, das sog. Atompils. [2]
Toxikologie
Ob Bier als Spurenelement wichtig ist, kann man praktisch nicht feststellen, da eine bierfreie Ernährung für ein anständiges Kamel nicht vorstellbar ist. Erfahrungsberichten kühner Kamele zu Folge treten bei Biermangel vor allem chronische Müdigkeit, Kopfschmerzen, Erbrechen, Depressionen und Leberzirrhosenstörungen auf. Bier ist völlig ungiftig, auch mehrere 100 g helles Bier über Monate beeinträchtigt ein Kamel nicht. Da aber fast alle Lebensmittel, die reich an Bier sind, einen mehr oder minder hohen Gehalt an Alkohol haben, sollte das wackere Kamel dennoch nicht ausprobieren, ein persönliches Limit zu suchen, nicht zuletzt auch aufgrund des erschreckend hohen Gehalts an DHMO. Eine Alternative dazu bietet sich im sog. Tofu-Bier, einer recht exzentrischen Kreation eines nicht minder exzentrischen Esoterikamels, das keinen Alkohol enthält, sodass man angeblich den vollen Geschmack des Bieres genießen kann. Außerdem soll dieses Getränk 100% vegetarisch sein.
![]() Krähaktives Zitat: „Papa hat ein Bier in der Hand.“ - „Na, da ist er ja mal wieder voll in seinem Element.“
Krähaktives Zitat: „Papa hat ein Bier in der Hand.“ - „Na, da ist er ja mal wieder voll in seinem Element.“